Mikronährstoffe haben ein bedeutendes präventives Potential
Das gesamte Gefäßendothel kann als größtes Organ des Körpers mit endokrinen und parakrinen Eigenschaften betrachtet werden. Das gesunde Endothel verhindert die Leukozyten- und Thrombozyten-Aggregation, wirkt antiinflammotorisch, vasodilatorisch und vermindert den oxidativen Stress an den Gefäßwänden. Endothelzellen setzen zahlreiche Stoffe frei, die einen dilatierenden Einfluss auf die Blutgefäße ausüben. Dazu gehört neben PGI 2 das Stickstoffmonoxid (NO), das über eine cGMP-Erhöhung in den Gefäßmuskelzellen die Erschlaffung auslöst. Auch andere dilatierende Stoffe, z.B. Acetylcholin, Bradykinin und Serotonin, wirken über eine sekundäre NO-Freisetzung aus dem Endothel.
Bei Endothelschädigung und endothelialer Dysfunktion werden signifikant häufiger kardiovaskuläre Ereignisse beobachtet. Wichtige pathogenetische Faktoren sind das oxidierte LDL und das Homocystein.
Oxidiertes LDL
LDL-Partikel besehen in ihrem Kern zum überwiegenden Teil aus Cholesterinestern und nur zu einem kleinen Teil aus Trigylceriden. Sie besitzen nur eine Apolipoprotein-Komponente, das Apo-B100, und transportieren etwa 80 % des gesamten Plasmacholesterins. LDL-Partikel werden zu ca. 70 % über den LDL-Rezeptor aus der Blutzirkulation entfernt; das zentrale Organ hierfür ist die Leber. Eine Störung des LDL-Stoffwechsels gilt als wichtigste Ursache für die Entstehung der Atherosklerose. Apo-B100-Lipoproteine akkumulieren an der extrazellulären Matrix und an Proteoglycan-Strukturen der Gefäßwände. Dies erfolgt aufgrund der elektronegativen Ladung des Apo-B100.
Eine oxidative Veränderung des LDLs erfolgt hauptsächlich durch Superoxid-anionen, die von verschiedenen Enzymsystemen in der Gefäßwand gebildet werden. Der genaue Mechanismus, wie es zur LDL-Oxidation kommt, ist noch nicht vollständig geklärt. Die wichtigste Rolle spielt sicher der oxidative Stress, also das Missverhältnis zwischen Pro- und Antioxidantien. Chemisch modifiziertes LDL wird von Scavenger-Rezeptoren der Makrophagen aufgenommen, wodurch sich diese in Schaumzellen verwandeln. Das oxidierte LDL ist erheblich zytotoxisch, es hemmt die Motilität der Gewebsmakrophagen und führt zu einer Hyperkoagulabilität im Bereich der lokalen Gefäßregionen.
Bekanntlich ist Stickoxid, das aus der Aminosäure Arginin gebildet wird, der bedeutendste Vasodilatator. Ox-LDL stört die NO-Signaltransduktion durch vermehrte Bildung von Dimethylarginin, das die NO-Synthese hemmt. Ebenso wird Tetrahydrobiopterin, ein wichtiger Cofaktor der NO-Synthase, durch Ox-LDL zerstört. Die Verminderung der endothelialen NO-Produktion führt zu einer Herabsetzung der Gefäßdilatation. Der Ausfall der NO-Produktion begünstigt die Thrombinbildung und Thrombozytenaggregation; Gerinnungsvorgänge werden gefördert.
Homocystein
Trotz der Bedeutung der Blutplasmalipide für die Entwicklung einer KHK sind bei über der Hälfte der Myokardinfarkt-Patienten keine Hyperlipidämien nachweisbar. Ein weiterer wichtiger Risikofaktor der Gefäßerkrankungen ist das Homocystein. Homocysteinkonzentrationen über 15 µmol/ l wurden bei
20 bis 30 % aller Patienten mit atherosklerotischen Gefäßveränderungen festgestellt.
Wünschenswert ist eine Plasmakonzentration von unter 10 µmol/ l, darüber können bereits atherogene Effekte auftreten. Der Mechanismus, über den Homocystein zu vaskulären Schäden führt, ist erst teilweise aufgeklärt. Homocystein wird im Plasma zu Homocystein-Thiolacton und gemischten Disulfiden oxidiert unter gleichzeitiger Entstehung verschiedener Peroxide, die die vaskuläre Toxizität des Homocysteins erklären. Die Wasserstoffperoxidbildung führt auch zur Peroxidation von Membranlipiden, zur Oxidation von LDL-Partikeln und zu einer Aktivierung von Blutgerinnungsfaktoren.
Zum Schutz gegen die toxischen Effekte des Homocysteins wird von den Endothelzellen vermehrt NO gebildet und freigesetzt. NO reagiert mit Homocystein unter Bildung von S-Nitrosothiolen; dadurch wird die gefäßschädigende Wirkung des Homocysteins neutralisiert. Allerdings beeinträchtigt Homocystein den Arginintransport in die Endothelzellen, so dass mit zunehmenden Homocystein-Konzentrationen immer weniger NO gebildet wird.
Wie kann die Endothel-Dysfunktion beeinflusst werden?
Der NO-Metabolismus wird sowohl durch Ox-LDL als auch durch Homocystein gestört. Deshalb ist die Erhöhung der NO-Verfügbarkeit ein wesentliches Therapieprinzip zur Behandlung der endothelialen Dysfunktion. Arginin ist die Ausgangssubstanz zur Bildung von NO. Deshalb sollte bei Endothelschäden die Argininzufuhr verbessert werden. In mehreren Studien wurde nachgewiesen, dass Argininsupplemente wirksam sind zur Verbesserung der koronaren und peripheren Durchblutung und zur Reduzierung der endothelialen Dysfunktion.
Da Homocystein ein NO-Räuber ist, ist eine Senkung erhöhter Homocystein-Konzentrationen unerlässlich zur Normalisierung der Endothelfunktion. In den meisten Fällen kann Homocystein effektiv mit den Vitaminen B6, B12 und Folsäure gesenkt werden. Wie sich in einigen Studien gezeigt hat (Wales Heart Research Institute), besitzt Folsäure auch einen eigenständigen therapeutischen Effekt auf die Endothelfunktion, der mit dem Homocystein-Metabolismus nichts zu tun hat. Eine Verbesserung der NO-Verfügbarkeit kann auch dadurch erfolgen, dass die Oxidation des LDL verzögert wird. Dazu ist eine ausreichende Antioxidantienzufuhr erforderlich.
Vitamin E ist das wichtigste liphophile Antioxidans und hat sich in mehreren Studien (Monica Study, Nurses Health Study, Health Professionals Follow-Up-Study) als wirksam in der Prävention von Herz-Kreislauferkrankungen erwiesen. Vitamin E hemmt nicht nur die LDL-Oxidation, sondern hat auch mehrere andere gefäßschützende Wirkungen. Es hemmt die Thrombozytenaggregation durch Beeinflussung des Arachidonsäure-Metabolismus, es schützt NO vor oxidativem Abbau, vermindert die Monozytenadhäsion und hat antiinflammatorische Eigenschaften.
Auch Vitamin C allein kann die LDL-Oxidation vermindern und die HDL-Konzentration erhöhen. Allerdings ist der Stellenwert einer Vitamin-C-Supplementierung zur Prävention von Atherosklerose und KHK aufgrund der derzeit publizierten Studienergebnisse noch nicht definitiv erwiesen. Unbestritten ist die synergetische Wirkung von Vitamin E und Vitamin C in der Prävention der Atherosklerose. Dies ist auch biochemisch sehr gut nachvollziehbar.
Für Beta-Carotin als Einzelsubstanz konnte kein protektiver Effekt gegen KHK nachgewiesen werden. Demgegenüber hat eine carotinoidreiche Ernährung, die bekanntlich eine Vielzahl antioxidativer Wirkstoffe enthält, einen Schutzeffekt. Vegetarier haben eine bessere Endothelfunktion und eine höhere Oxidationsstabilität des LDLs. Verschiedene Thiolverbindungen wie NAC, Cystein, Glutathion, Alpha-Liponsäure können ebenfalls die LDL-Oxidation verhindern. Carnitin, besonders in Form von LPropionyl-Carnitin, hat einen positiven Effekt auf die Durchblutung.
Da die Glutathionperoxidasen eine wichtige Rolle beim Schutz der Zellmembranen spielen, ist eine ausreichende Selenversorgung anzustreben.
Gerade zur Prävention von Herz-Kreislauferkrankungen sind in der Orthomolekularen Medizin mehrere Substanzen verfügbar, die nachgewiesenermaßen einen protektiven Effekt auf die Endothelfunktion haben. Grundlage einer effektiven orthomolekularen Therapie ist eine entsprechende Labordiagnostik. Das folgende Fallbeispiel eines 58 -jährigen Patienten mit Hypercholesterinämie, KHK und arterieller Hypertonie zeigt auf, welche Informationen und therapeutische Konsequenzen aus einem Mikronährstoffprofil gewonnen werden können.
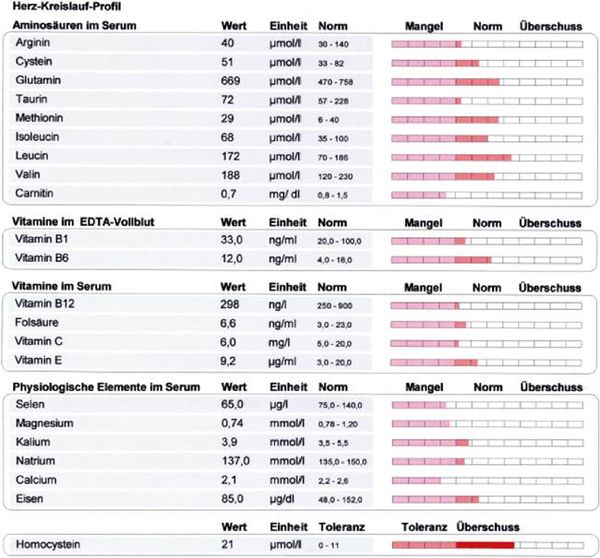
- Arginin ist relativ niedrig.
Arginin ist die Ausgangssubstanz für die Bildung von NO-Bildung, das maßgeblich den Gefäßtonus reguliert. - Taurin ist suboptimal.
Taurin hat antiarrhythmische und positiv inotrope Eigenschaften und wirkt antihypertensiv.
Taurinsupplemente können Cholesterin senken. - Carnitin ist vermindert.
Carnitin verbessert den Energiestoffwechsel des Herzmuskels. - Hyperhomocysteinämie.
Homocystein ist ein Risikofaktor für Gefäßerkrankungen, inaktiviert NO und erhöht den Argininbedarf. - Folsäure und Vitamin B12 sind suboptimal.
Beinträchtigung des Homocysteinabbaus. - Vitamin B1 sollte eine höher Konzentration haben, da wichtig für den Laktatabbau.
Referenzen:
- Jane Higdon, Ph. D.: An Evidence-Based Approach to Vitamins and Minerals, Thieme 2003
- David A. Bender: Nutritional Biochemistry of the Vitamins; second edition, Cambridge University Press 2003
- E. Buddecke: Molekulare Medizin; Ecomed 2002
- Walter Siegenthaler: Klinische Pathophysiologie; 8. Auflage, Thieme 2001
Veröffentlicht:
CO`MED Nr. 7/ 2004; Autor: Dr. med. Hans-Günter Kugler
